¿Cómo se forma la concha de moluscos?
La biomineralización es un fenómeno biológico mediante el cual los organismos forman de manera controlada compuestos inorgánicos. Las conchas de moluscos están construidas mayormente con un material frágil como el carbonato de calcio, sin embargo, algunos de sus polimorfos alcanzan tensiones de fractura de más de un orden de magnitud superiores a los compuestos puros de origen mineral. La cristalización es dirigida por procesos bioquímicos con deposición alternada de cristales de aragonita, calcita o nácar y una matriz orgánica, constituida por proteínas, quitina y polisacáridos, que no excede el 1% en volumen. El mecanismo por el cual las conchas son sintetizadas aún no es claro, por lo que el estudio de las proteínas de la concha es necesario para poder entender su papel en el proceso de formación de la concha. En esta revisión, se describen las conchas de moluscos, las diferentes arquitecturas que presentan, así como las moléculas y mecanismos propuestos en el proceso de biomineralización de estas estructuras y su importancia tanto biológica como biotecnológica. Palabras clave: biomineralización, moluscos, calcita, aragonita
Centro de Investigaciones Biológicas del Noroeste (CIBNOR), La Paz, Baja California Sur, México.
Formación concha de moluscos La concha de moluscos Las conchas de moluscos son uno de los minerales biogénicos más abundantes. Están compuestas por 99% de carbonato de calcio y 1% de una matriz orgánica (Lowenstam y Weiner, 1989). Las capas de la concha están formadas de diferentes polimorfos de carbonato de calcio, como son aragonita, calcita o nácar, lo que produce diferentes microestructuras de estos minerales. La matriz orgánica de la concha está constituida por proteínas, quitina y polisacáridos, los cuales juegan un papel fundamental en la formación de los cristales de carbonato (Zhang y Zhang, 2006). Las proteínas de la matriz o SMPs (por sus siglas en inglés, shell matrix proteins) se sintetizan en las células epiteliales de diferentes regiones del manto de moluscos.
La SMPs que se sintetizan en la parte externa del manto se han asociado con la formación de calcita, mientras que la región dorsal está relacionada con la formación de aragonita (Zhang y Zhang, 2006). En la mayoría de los moluscos, la capa externa o periostraco, está formada de compuestos orgánicos y no está calcificada (Checa y Harper, 2010). Las capas internas están formadas de polimorfos de aragonita y/o calcita, y raras veces vaterita. Las diferencias entre los polimorfos formados y la estructura que forman, generan diferentes microestructuras complejas que presentan una arquitectura precisa a diferentes escalas tales como prismática, nacarada, foliada, lamelar cruzada o microestructuras homogéneas (Carter, 1990; Chateigner et al., 2000; Furuhashi et al., 2009).

Estas estructuras contribuyen a la resistencia y fuerza de la microestructura sintetizada proveyendo funciones biológicas como soporte estructural y/o protección para el organismo (Weiner y Addadi, 1997). La estructura prismática de la concha de moluscos está compuesta de calcita con forma, tamaño y orientación regular. En este arreglo cada molécula de calcita tiene un ángulo de 10-20° con respecto a otra, formando placas regulares que se distancian 1 µm y tienen estructura de fibras paralelas (Mutvei, 1989). La capa de nácar, el cual es iridiscente, se encuentra en la parte interna de la concha de moluscos, está compuesta de capas alternadas de materia orgánica y de placas de aragonita con forma poligonal y con un grosor de 0.5 µm y un diámetro de 5-8 µm.
Las placas forman una arquitectura de ladrillo (o también conocido como brick-and-mortar, en inglés) (Liu et al., 1999), o bien se puede encontrar en forma de monedas apiladas ó columnar (stack of coins en inglés) (Fig. 1). Esta estructura compuesta de nácar le provee a la concha una rigidez que alcanza tensiones de fractura de más de un orden de magnitud superior a los compuestos puros de origen mineral. Por otro lado, la estructura foliada de la concha está compuesta de calcita, consiste en deposiciones planas (foliada) de elementos longitudinales orientados uniformemente, que se encuentran con la superficie de crecimiento de la concha en un ángulo de entre 10° y 30° (Checa et al., 2018). Finalmente, la estructura lamelar, la cual es la estructura más común en moluscos, está compuesta por aragonita (Dauphin y Denis, 2000).
El arreglo estructural difiere entre especies, pero la arquitectura básica es similar (Wilmot et al., 1992), los cristales de | 45 Rivera-Pérez, Hernández-Saavedra aragonita están posicionados como lamela con orientaciones alternadas en un ángulo de 70-90° dependiendo de la especie (Almagro et al., 2016). ¿Cómo se forman las conchas de moluscos? Moléculas involucradas Las SMPs, han sido ampliamente estudiadas con la finalidad de entender su papel en la formación de las diferentes capas de conchas de moluscos, mediante el proceso de biomineralización. Para la extracción de las SMPs, dos estrategias de disolución de la parte calcárea de la concha han sido implementadas, 1) extracción con ácido acético y 2) disolución con EDTA (Marie et al., 2015, 2016), clasificando de esta manera a las SMPs como solubles (fase acuosa de la extracción) e insolubles (fase no soluble de la extracción). Sin embargo, las SMPs también se han clasificado con base en su presencia en las diferentes capas de la concha de moluscos: 1) capa de aragonita, Figura 1. Arreglo estructural de la concha de moluscos. a) Ostra perlera Pinctada mazatlanica (bivalvos) y abulón azul Haliotis fulgens (gasterópodos), b) representación esquemática de la estructura de ladrillos de nácar en bivalvos y columnar en gasterópodos, e imagen representativa de microscopía electrónica de barrido de la concha de bivalvo mostrando el patrón de ambos moluscos y c) imágenes de microscopía electrónica de barrido de un corte transversal de la concha de un bivalvo y un gasterópodo, mostrando la estructura de nácar de ladrillo y columnar, respectivamente. Fotografías de moluscos de: Fausto Valenzuela Quiñonez.
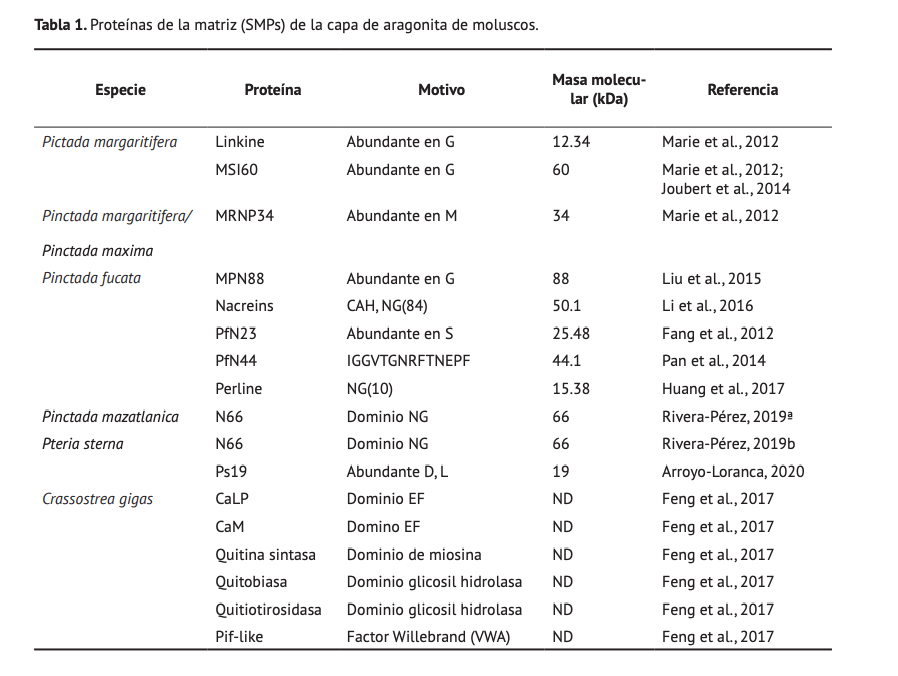
Las SMPs de la capa de aragonita, son las responsables de la formación de la capa interna de las ostras perleras. A diferencia de la calcita, el nácar ha mostrado ser biocompatible con la formación de hueso, es biodegradable in vitro e in vivo, y tiene propiedades osteogénicas (López et al., 2000; Rousseau et al., 2003; Shen et al., 2006; Flausse et al., 2013), lo que hace que sea de interés para la industria de biomateriales para su uso en ingeniería de tejidos. Una gran variedad de proteínas de la capa de aragonita han sido descritas en los últimos diez años (Tabla 1), sin embargo, la mayoría de los estudios están limitados al bivalvo Pinctada fucata.
La composición aminoacídica de estas proteínas se caracteriza por secuencias repetidas de una limitada proporción de aminoácidos (e.g. GG, MM, NG, IGGVTGNRFTNEPF, etc.). Así mismo, las SMPs presentan dominios conservados que juegan un papel importante en la formación de la concha, tal es el caso del dominio Willebrand factor tipo A (VWA), unión a quitina, anhidrasa carbónica (CAH), y dominios ácidos (Li et al., 2016; Feng et al., 2017). Además de las propiedades intrínsecas de la secuencia de aminoácidos, las SMPs de la concha de aragonita están sujetas a regulación postraduccional como el acoplamiento de fósforo (fosforilación), fosfatos (fosfatación) y carbohidratos (glicosilaciones) (Matsushiro et al., 2003); estas modificaciones se han asociado con la capacidad de interacción Especie Proteína Motivo Masa molecular (kDa) Referencia Pictada margaritifera Linkine Abundante en G 12.34 Marie et al., 2012 MSI60 Abundante en G 60 Marie et al., 2012; Joubert et al., 2014 Pinctada margaritifera/ Pinctada maxima MRNP34 Abundante en M 34 Marie et al., 2012 Pinctada fucata MPN88 Abundante en G 88 Liu et al., 2015 Nacreins CAH, NG(84) 50.1 Li et al., 2016 PfN23 Abundante en S 25.48 Fang et al., 2012 PfN44 IGGVTGNRFTNEPF 44.1 Pan et al., 2014 Perline NG(10) 15.38 Huang et al., 2017 Pinctada mazatlanica N66 Dominio NG 66 Rivera-Pérez, 2019ª Pteria sterna N66 Dominio NG 66 Rivera-Pérez, 2019b Ps19 Abundante D, L 19 Arroyo-Loranca, 2020 Crassostrea gigas CaLP Dominio EF ND Feng et al., 2017 CaM Domino EF ND Feng et al., 2017 Quitina sintasa Dominio de miosina ND Feng et al., 2017 Quitobiasa Dominio glicosil hidrolasa ND Feng et al., 2017 Quitiotirosidasa Dominio glicosil hidrolasa ND Feng et al., 2017 Pif-like Factor Willebrand (VWA) ND Feng et al., 2017 Tabla 1. Proteínas de la matriz (SMPs) de la capa de aragonita de moluscos. | 47 Rivera-Pérez, Hernández-Saavedra entre la proteína y el carbonato de calcio y su rol potencial como reguladores de la formación de sus polimorfos (Zhang y Zhang, 2006).
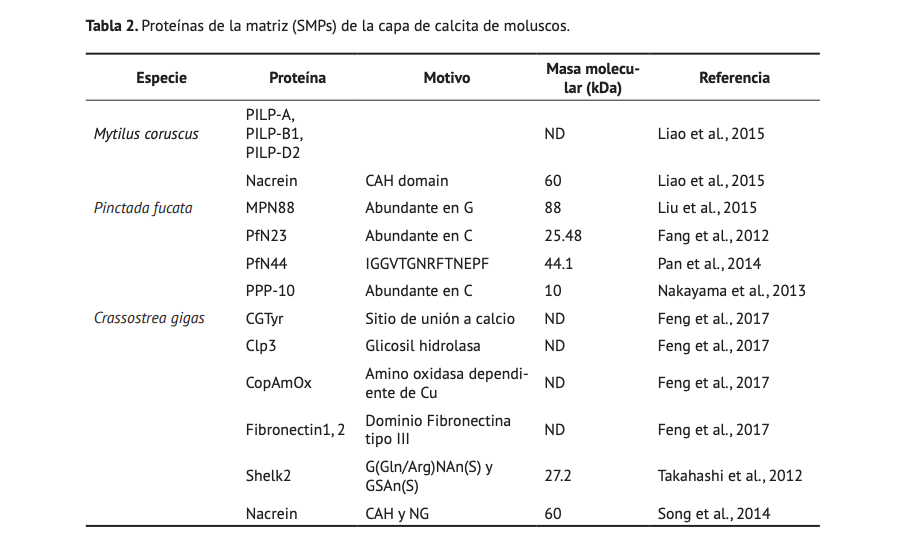
Las SMPs de la capa de calcita estudiadas actualmente son limitadas (Tabla 2), aún cuando la proporción de moluscos que contienen este polimorfo es superior que los que contienen nácar. Además de las proteínas con capacidad de precipitación de carbonato de calcio (e.g. nacreína), existen proteínas de la capa de calcita que han sido identificadas como protectoras de las SMPs, tal es el caso de las PILPs, las cuales previenen la proteólisis de las SMPs en el espacio extrapaleal de moluscos (Bédouet et a., 2007; Jeffroy et al., 2013). Por otro lado, componentes de la matriz orgánica como la quitina en conjunto con las SMPs, juegan un papel sinérgico para la formación de las placas de calcita y la ausencia de quitina genera polimorfos de calcita deformados afectando la formación de la concha en moluscos (Kintsu et al., 2017). Si bien, existen SMPs específicas de cada capa de la concha de moluscos (Tablas 1 y 2), es evidente que existen proteínas que se encuentran en las dos capas de la concha, tal es el caso de nacreína, MPN88 y Pf23, entre otras.
La presencia de proteínas en ambas capas de la concha de moluscos sugiere que los moluscos tienen un grupo de proteínas básicas involucradas en la formación de capa prismática y nacarada, y además proteínas especializadas para cada una de las capas. Las proteínas básicas han sido descritas como proteínas involucradas en la biomineralización de la concha de moluscos que se comparten entre todos los moluscos existentes (Karakostis et al., 2016). Sin embargo, en la actualidad no existe un consenso en las proteínas que conforman este grupo de proteínas básicas involucradas en la formación de la concha, debido a la limitada información existente de las mismas. Especie Proteína Motivo Masa molecular (kDa) Referencia Mytilus coruscus PILP-A, PILP-B1, PILP-D2 ND Liao et al., 2015 Nacrein CAH domain 60 Liao et al., 2015 Pinctada fucata MPN88 Abundante en G 88 Liu et al., 2015 PfN23 Abundante en C 25.48 Fang et al., 2012 PfN44 IGGVTGNRFTNEPF 44.1 Pan et al., 2014 PPP-10 Abundante en C 10 Nakayama et al., 2013 Crassostrea gigas CGTyr Sitio de unión a calcio ND Feng et al., 2017 Clp3 Glicosil hidrolasa ND Feng et al., 2017 CopAmOx Amino oxidasa dependiente de Cu ND Feng et al., 2017 Fibronectin1, 2 Dominio Fibronectina tipo III ND Feng et al., 2017 Shelk2 G(Gln/Arg)NAn(S) y GSAn(S) 27.2 Takahashi et al., 2012 Nacrein CAH y NG 60 Song et al., 2014 Tabla
2. Proteínas de la matriz (SMPs) de la capa de calcita de moluscos. 48 | Revista Digital de Divulgación Científica, 2020 Formación concha de moluscos Mecanismo propuesto de biomineralización en moluscos Actualmente, se desconoce el mecanismo exacto de cómo las SMPs llevan a cabo la biomineralización de la concha de moluscos, pero se han identificado los elementos principales que participan en este proceso (Addadi et al., 2006): 1.- La fase de seda: es un gel que cubre los espacios de las estructuras mineralizadas. 2.- Quitina: participa en la fase estructural que dicta la orientación de los cristales maduros.
3.- Los componentes de la matriz: estos están diferenciados entre las capas.
4.- Primer mineral formado (ACC): coloide amorfo de carbonato de calcio.
5.- Nucleación: ocurre en la matriz, y el cristal crece a expensas de la fase ACC.
6.- Oclusión de las SMPs: durante la fase de crecimiento del cristal, algunas proteínas ácidas quedan ocluidas dentro del cristal. El proceso de biomineralización propuesto hasta ahora incluye cuatro etapas: 1) Ensamblaje de la matriz. Las SMPs son sintetizadas en las células epiteliales del manto y son liberadas al espacio extrapaleal, donde interactúan con iones inorgánicos y otros compuestos orgánicos como quitina para llevar a cabo la precipitación de carbonato de calcio (Addadi et al., 2006; Rousseau et al., 2009). 2) Fase de formación del primer mineral (ACC). La primera precipitación de carbonato de calcio ó ACC (por sus siglas en inglés Amorphous calcium carbonate), es el precursor de aragonita y calcita, la formación de cada una está precedida de cristales nacientes de aragonita y calcita respectivamente (Addadi et al., 2006). 3) Nucleación de placas individuales de aragonita. En este paso, dos teorías han sido establecidas. La primera teoría sugiere que antes del crecimiento de los cristales se da una pre-nucleación donde el ACC se une con una solución saturada de carbonato de calcio en un arreglo de 1 a 3 nm de distancia (Gebauer et al., 2014) y las diferencias de estos arreglos deben diferenciar entre la formación de calcita y aragonita (Evans, 2017). La segunda teoría es la cristalización por unión de partícula o CPA (por sus siglas en inglés, crystallization by particle attachment) (De Yoreo et al., 2015).
En la nucleación por CPA, los constituyentes iónicos pueden formar varios tipos de partículas que, posteriormente, se pueden ensamblar para formar los diferentes tipos de polimorfos (Kalikmanov, 2013). 4) Crecimiento de las placas para formar un tejido maduro (concha). Los polimorfos de carbonato de calcio crecen verticalmente, hasta que se encuentran con una placa de quitina. Posteriormente, el cristal empieza a crecer lateralmente. Durante este proceso, proteínas ácidas de la matriz se incorporan entre cada placa generada (Addadi et al., 2006). | 49 Rivera-Pérez, Hernández-Saavedra Si bien las etapas del proceso de biomineralización están delimitadas y algunos de los componentes del proceso han sido identificados, son necesarios más estudios de la funcionalidad de las SMPs para poder entender el papel sinérgico de las SMPs en la formación de la concha, ya que no sólo es una SMP la que participa en el proceso sino un grupo de proteínas, que sabemos presentan diferencias sustanciales en secuencia y función. Consideraciones finales y perspectivas La gran diversidad de SMPs de moluscos sugiere la existencia de un grupo de proteínas básico involucrado en la biomineralización de la concha de moluscos. Por lo que, la identificación de este grupo de proteínas y su respectiva función es importante para: 1) entender el rol de cada SMPs en el proceso de biomineralización y 2) evaluar la susceptibilidad de los organismos a adaptarse a cambios ambientales.
Este último punto, permitiría entender como las microestructuras de la concha impactan en la plasticidad de la concha y la habilidad de los organismos de hacer frente al cambio climático. Por ejemplo, estudios recientes mostraron una correlación entre el crecimiento de la concha, los niveles de expresión de once genes involucrados en el proceso de biomineralización y la temperatura, sugiriendo que existen límites de temperatura que están relacionados con los límites ecológicos de las especies, ya que se sabe que ambientes con niveles reducidos de hidratación (como alta temperatura o soluciones con constantes dieléctricas bajas) favorecen la formación de polimorfos de aragonita (Shen et al., 2006; Joubert et al., 2014). Además de la importancia biológica de entender el proceso de biomineralización en moluscos, también provee una oportunidad para emplear estas proteínas para el diseño de materiales biomiméticos mediante la manipulación de las SMPs para la formación específica de polimorfos de calcita y/o aragonita.
Agradecimientos A CIBNOR por los fondos proporcionados. Asimismo se agradece al Lic. Gerardo Hernández el Diseño gráfico editorial. Literatura citada Addadi, L., D. Joester, F. Nudelman y S. Weiner. 2006. Mollusk shell formation: A source of new concepts for understanding biomineralization processes. Chemical European Journal 12: 980–987. Almagro, I., P. Drzymała, K. Berent, C.I. Saínz-Díaz, M.G. Willinger, J. Bonarski y A. G. Checa. 2016. New crystallographic relationships in biogenic aragonite: the crossed-lamellar microstructures of mollusks. Crystal Growth and Design. 16: 2083–2093. 50 | Revista Digital de Divulgación Científica, 2020 Formación concha de moluscos Arroyo-Loranca, R.G., Hernández-Saavedra, N.Y., Hernández-Adame, L. y C. Rivera-Pérez. 2020. Ps19, a novel chitin binding protein from Pteria sterna capable to mineralize aragonite plates in vitro. PLoS ONE 15: e0230431. Bédouet, L., D. Duplat, A. Marie, L. Dubost, S. Berland, M. Rousseau, C. Milet y E. López. 2007. Heterogeneity of proteinase inhibitors in the water-soluble organic matrix from the oyster
*Autor de correspondencia: Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo. Imágen: Gerardo Hernández , CIBNOR 44 | Revista Digital de Divulgación Científica, 2020
